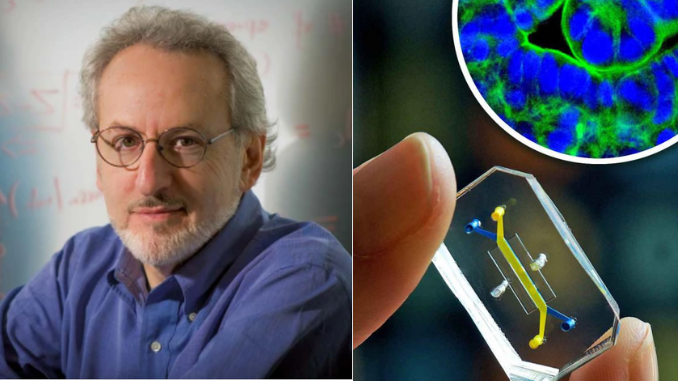
Nature Reviews Materials parla con Donald Ingber, direttore fondatore del Wyss Institute for Biologically Inspired Engineering dell’Università di Harvard, dell’enigma della sperimentazione animale e dell’importanza dei modelli rilevanti per l’uomo nella ricerca biomedica.
I modelli animali sono comunemente usati per studiare malattie e trattamenti destinati all’uomo, tuttavia, sono spesso limitati nella loro capacità di mimare le condizioni umane, in particolare, a livello molecolare e cellulare. Perché li stiamo ancora usando?
La prima e breve risposta è che li usiamo perché ci sono, e perché li abbiamo usati in passato e sappiamo come lavorare con modelli animali. In secondo luogo, molti modelli in vitro sono troppo semplificati per prevedere le condizioni in vivo. Uno dei principali poteri dei modelli animali è la possibilità dell’ingegneria genetica, basata su specifiche alterazioni genetiche che sospettiamo possano essere coinvolte. La domanda è se ci stiamo prendendo in giro, perché ci convinciamo che ciò che vediamo è ciò che pensavamo dovesse essere. In effetti, molti farmaci passano prima attraverso modelli animali prima di raggiungere gli studi clinici e la grande maggioranza di questi farmaci fallisce una volta testata sull’uomo. Naturalmente, ci sono anche considerazioni etiche quando si tratta di modelli animali.
Ma ora siamo a un punto in cui abbiamo a disposizione modelli in vitro molto più complessi, che vanno dagli organoidi, agli organi su chip, ai sistemi micro-fisiologici. Questi modelli sono addirittura migliori dei modelli animali. Tuttavia, queste piattaforme devono essere adatte allo scopo, perché non sono generiche. Non esiste un modello in vitro che possa sostituire tutti i modelli animali. C’è bisogno di modelli diversi anche per un organo, come il polmone. Modelli distinti per l’asma, la fibrosi polmonare o l’edema polmonare, per esempio. Lavoriamo con modelli animali, perché spesso mostrano fenotipi che sembrano quelli di una malattia umana, ma i meccanismi molecolari e cellulari sottostanti possono essere molto diversi. Inoltre, alcune tecnologie, come gli RNA CRISPR terapeutici o gli anticorpi monoclonali, non funzionano affatto nei modelli animali, perché sono specifici per le sequenze bersaglio umane. Allo stesso modo, le risposte ai vaccini spesso non sono rappresentative nei modelli animali, nemmeno nei primati non umani.
Tuttavia, per molto tempo non c’era davvero alcuna alternativa ai modelli animali. Ovviamente, dobbiamo studiare i modelli animali a causa delle applicazioni che collegano la salute degli animali, la salute umana e l’ambiente, l’ecotossicologia. Tuttavia, puoi anche creare organi di animali su chip, come un intestino di pipistrello su un chip. In questo modo, le infezioni zoonotiche possono essere studiate anche utilizzando piattaforme in vitro, e si può anche applicare l’ingegneria genetica agli organi su chip. Ora siamo in una fase in cui possiamo creare dei sistemi in vitro specie-specifici.
Molti editori, agenzie di finanziamento e agenzie di regolamentazione spesso impongono l’uso massiccio di modelli animali. Ritiene che questi requisiti debbano essere messi in discussione?
Assolutamente. Penso che se i revisori fossero consapevoli che là fuori esistono modelli alternativi, potrebbero richiedere la convalida in un modello rilevante per l’uomo piuttosto che in un modello animale. Molti revisori, tuttavia, non conoscono questi nuovi modelli in vitro, come gli organi umani su chip o altri tipi di sistemi microfisiologici complessi. I revisori danno consigli validi, ad esempio, per considerare la situazione a livello di organismo intero o la farmacocinetica; tuttavia, un modello animale spesso potrebbe non essere il modello migliore per studiare questi aspetti. Ad esempio, abbiamo scoperto che i movimenti respiratori influenzano il tasso di crescita e invasione del cancro del polmone in un chip polmonare umano. In questo caso sarebbe stato impossibile utilizzare un modello animale, perché, ovviamente, non possiamo mantenere in vita un animale per tre settimane senza respirare. Tuttavia, questo è stato richiesto da un revisore.
Chiedere modelli animali è spesso un riflesso, perché è così che si fa da molti anni, anche nei casi in cui è noto che i modelli animali non replicano la fisiologia o la fisiopatologia umana.
Sarebbe giusto ed importante chiedersi quale sia il modello migliore disponibile per il confronto, il modello più rilevante per l’uomo, e poi dovrebbe essere utilizzato questo modello. Nelle mie discussioni passate, anche la FDA ha suggerito che i modelli in vitro potrebbero essere utili se altrettanto buoni quanto i modelli animali, e non necessariamente migliori, a condizione che siano basati sulla biologia umana, robusti e convalidati. Gli stessi criteri dovrebbero essere applicati anche dai revisori di pubblicazioni e progetti di ricerca da finanziare.
Ritiene che esista una barriera verso l’utilizzo di piattaforme in vitro invece di animali, in particolare, per i ricercatori che non sono anche ingegneri?
Le persone tendono a fare ciò per cui sono state addestrate e usano metodi con cui si sentono a proprio agio. Ci vuole energia per conoscere le nuove tecnologie, le loro sfumature e i loro limiti. Tuttavia, al giorno d’oggi, non è davvero necessario conoscere l’ingegneria per utilizzare i sistemi organ-on-a-chip. Ci sono anche fornitori commerciali. Ma devi adattarti a questi nuovi sistemi, magari eseguire ulteriori controlli per confrontare i dati precedenti e per assicurarti che siano robusti. Quindi, sì, c’è una barriera verso l’utilizzo di nuove piattaforme in vitro. Fondamentalmente, dobbiamo cambiare il modo in cui facciamo le cose.
Ha sviluppato e lavorato su sistemi organ-on-a-chip per molti anni e ora sono disponibili chip con una complessità molto elevata, che sono in grado di mimare la fisiologia umana. Tuttavia, la mancanza di componenti immunitarie e di indagini sistemiche è spesso criticata. Pensa che questa sia una critica valida? E come potrebbe essere affrontato il problema?
Voglio fare un esempio sull’integrazione del compartimento immunitario. Abbiamo lavorato sull’edema polmonare indotto da interleuchina-2, un messaggero prodotto dal sistema immunitario che se in eccesso causa danno vascolare polmonare, e che abbiamo riprodotto su un chip. Potremmo chiaramente mostrare l’edema polmonare indotto dall’interleuchina-2 senza la necessità di cellule immunitarie, cosa che non è possibile fare in un modello animale o in una sperimentazione clinica sull’uomo.
Allo stesso modo, puoi usare i chip per disaccoppiare gli effetti della meccanica e del flusso di fluidi. Si tratta essenzialmente di un approccio di biologia sintetica a livello di cellule, tessuti e organi che ci permette di applicare una sorta di metodologia einsteiniana; cioè, identificare i sistemi più semplici che possono ricapitolare la complessità in vivo della domanda che ti interessa. Ad esempio, se sono interessato a studiare l’interazione tra cellule epiteliali polmonari ed endoteliali dei vasi sanguigni, non ho necessariamente bisogno di cellule immunitarie.
Ma ovviamente, possiamo anche aggiungere il compartimento immunitario e altri componenti alle piattaforme su chip: lo facciamo quando non possiamo replicare accuratamente un fenotipo in loro assenza. Ad esempio, è possibile aggiungere cellule immunitarie circolanti e mostrare il reclutamento e l’adesione iniziale dipendente dallo stress da taglio all’endotelio che riveste i nostri chip polmonari. In effetti, vedo questo come uno dei grandi vantaggi di questi sistemi. Possiamo aggiungere componenti uno alla volta e controllarli in modo indipendente. Ad esempio, abbiamo realizzato un follicolo linfoide su un chip e testato un vaccino antinfluenzale. Abbiamo potuto replicare la formazione del centro germinativo, il cambio di classe di anticorpi e la produzione di IgG e abbiamo rilevato le stesse citochine osservate negli esseri umani che hanno ricevuto lo stesso vaccino commerciale. Ora stiamo anche testando gli effetti di nuovi adiuvanti immunitari in queste piattaforme.
Allo stesso modo, abbiamo sviluppato un midollo osseo su chip, che contiene il lignaggio ematopoietico. Altri gruppi hanno anche incorporato cellule immunitarie in tali sistemi. È importante sottolineare che se puoi replicare la fisiologia con un sistema semplice, hai un controllo sul controllo.
Un vantaggio dei sistemi microfluidici su chip che studiamo è che forniscono un’ampia visione sulle attività su scala molecolare all’interno delle cellule viventi in un contesto fisiologicamente rilevante, comprese le interfacce tessuto-tessuto, nonché i parametri di flusso, le interfacce aria-liquido e i movimenti meccanici.
Inoltre, utilizzando gli organi su chip è possibile visualizzare e analizzare la stessa posizione più e più volte nel tempo. Questo non è possibile in modelli più complessi come organoidi o modelli animali. Vedo gli organi su chip come sezioni trasversali 3D viventi delle principali unità funzionali di organi umani o animali, che possiamo analizzare nel tempo. Possiamo persino coltivare il microbiota umano in associazione con l’intestino o altri organi, usando organi su chip. La scoperta dell’importanza del microbiota è uno dei principali cambiamenti di paradigma in medicina negli ultimi 15 anni e non è possibile studiare il microbiota umano negli animali, perché hanno una diversa composizione e struttura microbica.
Quindi, per quanto riguarda la sua domanda iniziale, tutto si riduce al fatto che il meccanismo in questione implichi una risposta immunologica. In tal caso è ovviamente necessario aggiungere i componenti pertinenti.
Quali sono le prossime importanti pietre miliari negli organi su chip, in particolare, dal punto di vista della scienza dei materiali e dell’ingegneria?
Alcune delle sfide più grandi sono la necessità di più letture e sensori integrati. L’idea è di equipaggiare i chip in modo da poter ottenere più letture contemporaneamente, in particolare, per quanto riguarda i parametri cellulari, biochimici e persino genetici.
Inoltre, è necessario un rendimento più elevato, con la possibilità di analizzare più canali singoli in parallelo, con l’aggiunta di visualizzazioni ad alta risoluzione e analisi molecolari automatizzate in piccoli volumi. Abbiamo bisogno di ottenere il massimo delle informazioni da questi sistemi, in tempo reale.
Per quanto riguarda la scienza dei materiali, c’è sicuramente bisogno di materiali migliori che siano otticamente chiari, flessibili e biocompatibili. Usiamo il polidimetilsilossano (PDMS), perché è semplice, economico e permeabile ai gas, ma può anche assorbire alcuni piccoli farmaci.
Quindi, le alternative sarebbero benvenute. Inoltre, trovare nuovi modi per fabbricare in serie a basso costo questi chip è importante per la commercializzazione. Allo stesso modo, le tecniche per unire gli strati di materiale sono fondamentali per la strumentazione dei chip per impedire che i materiali si stacchino col flusso di liquido.
C’è anche una proposta per avviare un nuovo istituto presso il National Institutes of Health (NIH) incentrato su modelli in vitro innovativi, che potrebbe aiutare a costruire il numero di persone che hanno familiarità con questa opportunità. Ciò dovrebbe aiutare a raggiungere una massa critica di ricercatori che utilizzano questa tecnologia, che agiranno quindi come revisori di pubblicazioni, progetti di ricerca da sovvenzionare, ecc. Coinvolgere più ricercatori può aiutare a spingere la tecnologia oltre i limiti, in modo tale che le persone inizino a guardare oltre i modelli animali.
Bibliografia
Horejs, C. Organ chips, organoids and the animal testing conundrum. Nat Rev Mater 6, 372–373 (2021). https://doi.org/10.1038/s41578-021-00313-z