Il cancro al seno è il cancro più comune nelle donne e responsabile di molteplici decessi in tutto il mondo.
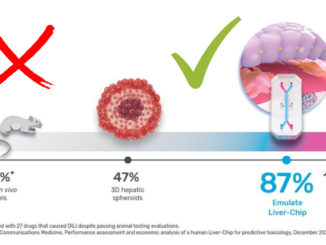
I modelli animali sono ancora considerati il punto di riferimento principale nello studio della fisiologia dei tumori e nella validazione di composti promettenti per il trattamento del cancro. Tuttavia, la stragrande maggioranza dei farmaci (il 90%), che hanno superato con successo i test preclinici, fallisce nelle fasi cliniche. La percentuale di fallimenti è dell’85% nelle prime fasi cliniche, e solo la metà di quelli che arrivano alla fase III vengono approvati per l’uso clinico. La maggior parte dei fallimenti si verifica nei test dei farmaci per il cancro, principalmente a causa della mancanza di efficacia clinica (40-50%), tossicità incontrollabile (30%), proprietà farmacologiche scadenti (10-15%), e mancanza di necessità commerciali e piani strategici insoddisfacenti (10%).
Gli animali utilizzati per lo studio del cancro sopravvalutano di circa il 30% la probabilità di un trattamento efficace. Inoltre, l’impressione di efficacia può essere distorta perché molti risultati negativi spesso non vengono pubblicati. Solo circa un terzo degli studi sugli animali molto citati è stato verificato nei trial clinici, e solo l’8% ha superato con successo la fase I.
Il problema delle differenze tra specie può essere illustrato bene nel caso dei primati non umani: anche se c’è una differenza di solo l’1-2% di DNA rispetto agli esseri umani, gli scimpanzé non sono modelli ottimali perché questa piccola differenza si traduce in circa il 20% di differenze nelle proteine tra le specie (ad esempio proteine che costituiscono enzimi, anticorpi, ecc.).
Non sorprende quindi che in una valutazione di 108 agenti antitumorali, il valore predittivo positivo degli effetti tossici ottenuti negli studi preclinici con topo, ratto, cane e scimmia fosse del 0.65, e il valore predittivo negativo fosse del 0.5 per la tossicità umana. Altri fattori, come la mancanza di standard di buona pratica, l’ambiente di laboratorio (stress dovuto all’alloggio in gabbia) e l’uso di animali di un unico sesso, possono contribuire anch’essi allo scarso valore predittivo degli studi sugli animali.
Non è possibile sperare che il successo dei vaccini terapeutici contro il cancro sia migliore rispetto ai farmaci tradizionali, poiché su 23 trial clinici di fase II/III, 18 sono falliti.
Le colture monocellulari convenzionali in 2D sono insufficienti per valutare l’efficacia e la tossicità degli agenti antitumorali perché non riescono a mimare la complessità dell’organismo. La generazione di modelli tridimensionali con l’integrazione di vari tipi cellulari, nuovi materiali matriciali ed effetti meccanici consente una migliore comprensione della fisiologia del tumore e degli effetti dei farmaci rispetto alle colture convenzionali in 2D.
Nel suo articolo pubblicato sulla rivista scientifica International Journal of Molecular Sciences, Eleonore Fröhlich del Centro per la Ricerca Medica, Università Medica di Graz (Austria) riassume i componenti importanti dei modelli tridimensionali fisiologicamente rilevanti e descrive lo spettro dei modelli di cancro al seno tridimensionali, come ad esempio gli sferoidi, gli organoidi, il cancro al seno su chip e i tessuti bio-stampati.
“La generazione di sferoidi è relativamente standardizzata e facile da eseguire. I sistemi microfluidici su chip consentono il controllo dell’ambiente e l’inclusione di sensori e possono essere combinati con sferoidi o modelli bio-stampati. La forza della bio-stampa si basa sul controllo spaziale delle cellule e sulla modulazione della matrice extracellulare” afferma l’autrice.
E continua “Gli organoidi sono più adatti per gli studi di medicina personalizzata, ma tutte le tecnologie possono mimare la maggior parte degli aspetti della fisiologia del cancro al seno”.
L’autrice sottolinea inoltre come gli ingredienti di origine animale (ad es. siero fetale bovino) quali supplementi di coltura cellulare limitano la riproducibilità e la standardizzazione dei modelli tridimensionali elencati.
| Tecnologia | Vantaggi | Svantaggi | Applicazioni |
|---|---|---|---|
| Sferoidi | Produzione facile e standardizzata, inclusione di molte cellule | Poca controllo sulla formazione | Interazioni cellulari, angiogenesi, test di farmaci |
| Organoidi | Alta somiglianza al tumore primario | Non rappresentativo dell’intero tumore, impossibile per tutti i tumori | Interazioni cellulari, screening di farmaci per la medicina personalizzata |
| Sistemi microfluidici | Controllo spaziale e temporale, bassa richiesta di cellule, integrazione di sensori | Problemi di flusso (stress da taglio, bolle d’aria), geometria complessa, mancanza di ECM | Interazioni cellulari, angiogenesi, chemiotassi, intravasazione/estravasazione |
| Stampante 3D – Matrici naturali | Alta biocompatibilità, alta adesione cellulare, modulazione da parte delle cellule possibile | Variabilità di lotto, degradazione incontrollata | Ruolo di rigidità, migrazione, invasione, angiogenesi, ipossia |
| Stampante 3D – Matrici sintetiche | Altamente regolabile | Scarsa adesione cellulare, mancanza di biocompatibilità | Ruolo di rigidità, migrazione, invasione, angiogenesi, ipossia |
| Stampante 3D – Materiale composito | Proprietà biofisiche e biochimiche regolabili | Molto complesso, citotossicità, variazione tra lotti | Ruolo di rigidità e porosità, migrazione, invasione, angiogenesi, ipossia |
| Impalcature decellularizzate | Proprietà e composizione simili a quelle in vivo | Cambiamenti nelle proprietà durante il trattamento, agenti di trattamento residui | Interazioni cellulari |
Per approfondire:
Fröhlich E. The Variety of 3D Breast Cancer Models for the Study of Tumor Physiology and Drug Screening. Int J Mol Sci. 2023 Apr 12;24(8):7116. doi: 10.3390/ijms24087116. PMID: 37108283; PMCID: PMC10139112.