L’industria ha una necessità impellente di avere a disposizione metodiche di studio incentrate sulla biologia umana ed è per questo che sono nate e continuano a svilupparsi metodologie di ricerca human based quali sono i NAM. Tuttavia è necessario che le singole metodiche siano unite tra loro in quello che viene definito come il progetto NGRA (next-generation risk assessment) ovvero nella valutazione del rischio sulla base delle metodiche di prossima generazione incentrate sull’uomo. In quest’ottica nasce il progetto europeo RISK-HUNT3 acronimo di Risk assessment of chemicals integrating human-centric next-generation testing strategies promoting the 3Rs, che ha promosso l’integrazione in ambito tossicologico di metodi computazionali, metodi in vitro e biologia dei sistemi. Questo approccio si tradurrà con tutta probabilità in valutazioni più veloci e nel contempo maggiormente attendibili. L’attività sinergica di più scienziati si concentrerà dunque sull’individuazione delle metodiche più appropriate e sulla loro combinazione con il fine ultimo di definire dei protocolli validi e riconosciuti a livello normativo per sostanze chimiche, pesticidi, additivi alimentari e farmaci. Il modello di ricerca della tossicologia ha guardato per molto tempo esclusivamente alla sperimentazione animale che in virtù delle differenze interspecifiche, della difficoltà di riproporre patologie umane in ambito animale e ancora dell’alto tasso dei falsi positivi (candidato farmaco risultato dannoso nell’animale e dunque scartato ma che tale non è in ambito umano) è risultata inadatta a rispondere ai quesiti di ricerca in ambito tossicologico. Tuttavia, e questo è l’oggetto del presente studio, anche gli attuali NAM presentano delle limitazioni che vengono così riassunte:
- un singolo NAM non è in grado di identificare a pieno un rischio legato a end-point complessi; troppo spesso prevale tra i ricercatori l’atteggiamento di sostituire un test con un solo altro test, quando invece ne occorrerebbero molteplici;
- valutare il rischio con metodiche NAM tra loro combinate è difficoltoso;
- necessità di fissare soglie di assunzione giornaliera e di esposizione quotidiana ad una data sostanza, il tutto in modo più accurato di quanto avvenga ora e con dati derivanti dai NAM;
- mancanza di test nella tossicologia che studia gli effetti cronici, dovuto principalmente alla vitalità ridotta dei tessuti in uso.
Il progetto ha dunque concentrato in primis la sua attenzione nel biomonitoraggio dei dati derivanti dall’esposizione ai tossici nell’uomo, soprattutto in riferimento alla quantificazione tramite i concetti di inalazione, assunzione e contatto cutaneo. Tutti dati da rendere poi fruibili nei test in riferimento al circolo sanguigno e alle singole dinamiche d’organo; ancora ha cercato di fare il focus sulla capacità di biotrasformazione e di eliminazione rilevati in ambito umano tramite i test in vitro. Lo studio si concentrerà poi sia sulle molecole progenitrici, sia sui metaboliti da essi derivati e tossicologicamente rilevanti. Dopo aver ricavato tutti i dati tossicocinetici e tossicodinamici sulle sostanze d’interesse i medesimi saranno integrati nei modelli tossicologici utili alla valutazione del rischio. Un altro punto importante è stato quello di distinguere tra AOP meccanismo ad esito avverso e i cambiamenti precoci adattativi reversibili e non significativi.

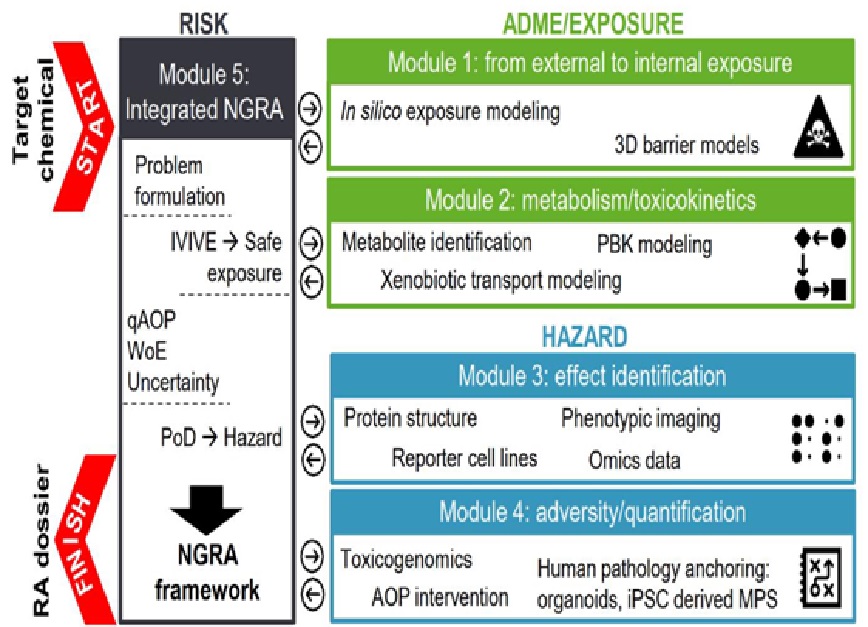
Come si può vedere nello schema tutto il procedimento volto a definire il rischio associato ad un determinato metabolita passa attraverso 4 step, che sono tra loro correlati ma che sono anche rigidamente strutturati. La prima fase è volta al reperimento del materiale e all’individuazione delle caratteristiche intrinseche della sostanza, sia tramite test in silico sia mediante test in vitro che simulano le barriere in 3D. Nella seconda i dati ottenuti vengono inseriti nei modelli di test che simulano i processi fisiologici di base, il focus è dunque sull’assorbimento, trasporto, metabolizzazione ed eliminazione della sostanza. Molto importante la decisione di approntare in questa seconda fase anche strategie di indagine per l’analisi dei metaboliti eventualmente tossici derivati dal composto primario oggetto di indagine. Solo quando si hanno tutti i dati necessari si procede con le terza e quarta fase che sono propriamente quelle dedicate alla caratterizzazione del rischio. Nella terza l’attenzione è tutta rivolta alla definizione degli AOP sia mediante test in silico, che mediante test in vitro, al fine di individuare il target d’azione e il meccanismo con il quale si realizza. La metodica è in grado di rilevare la maggior parte, sebbene non tutte, le forme di patogenicità. Di sicuro è in grado di individuare sempre il target d’organo colpito, la neurotossicità, e la carcinogenicità non genotossica. Infine abbiamo il modulo 4 che consente tramite sistemi avanzati che sfruttano organoidi, organi-on- chip e la tossicogenomica di valutare quanto precedentemente emerso e ricavare ulteriori dati in termini quantitativi e meccanicistici. Esiste poi un quinto step denominato IATA, che ha la funzione di integrare tra loro tutti i dati ricavati dai precedenti quattro step e verificarne il grado di incertezza complessiva.
Pallocca, G., Moné, M. J., Kamp, H., Luijten, M., van de Water, B. and Leist, M. (2022) “Next-generation risk assessment of chemicals – Rolling out a human-centric testing strategy to drive 3R implementation: The RISK-HUNT3R project perspective”, ALTEX – Alternatives to animal experimentation. doi: 10.14573/altex.2204051.



