Uno studio recentemente pubblicato sulla rivista Trends in Food Science & Technology, è frutto della collaborazione tra diversi gruppi di ricerca internazionali, attivi presso università e centri in Italia, Spagna e Cina. Gli autori afferiscono a istituzioni come l’Università Europea del Atlantico, l’Università Politecnica delle Marche, l’Università di Catania, la Jiangsu University e l’Università di Granada, con competenze che spaziano dalla nutrizione clinica alla biochimica alimentare, ai nuovi approcci metodologici. Il lavoro propone una revisione critica dei metodi utilizzati nello studio dell’asse intestino-cervello e mette in evidenza i limiti dei modelli animali e cellulari tradizionali. Al centro dell’analisi, la proposta di adottare le New Approach Methodologies (NAMs): modelli innovativi, human-based, che promettono di rivoluzionare la ricerca in nutrizione e nelle neuroscienze.
Negli ultimi anni, l’asse intestino-cervello si è affermato come uno dei campi più promettenti e affascinanti della ricerca biomedica. Questo sistema di comunicazione bidirezionale, che connette il tratto gastrointestinale al sistema nervoso centrale, svolge un ruolo cruciale nella regolazione dell’umore, del comportamento, della memoria, del metabolismo e della risposta immunitaria. Ma se le potenzialità terapeutiche legate alla modulazione di questa connessione sono enormi, lo sono anche le sfide metodologiche.
Oggi sappiamo che la dieta, attraverso l’interazione con il microbiota intestinale, può influenzare in modo sostanziale il nostro cervello. Tuttavia, molti degli strumenti usati finora per studiare questi effetti – in particolare i modelli animali e le colture cellulari tradizionali – si sono rivelati inadeguati per comprendere la complessità della biologia umana.
Quando il modello è il problema
Gran parte della ricerca sul microbiota e sull’asse intestino-cervello si è basata storicamente – e ancora si basa in gran parte – su modelli animali, come i topi germ-free. Questi studi hanno sicuramente permesso di identificare alcuni importanti meccanismi di base, ma presentano gravi limiti. Il microbiota umano, ad esempio, è molto diverso da quello murino per composizione, attività metabolica e risposta immunitaria. Anche le differenze neuroanatomiche e comportamentali sono sostanziali, rendendo spesso difficile trasferire i risultati agli esseri umani.
Anche i modelli in vitro più comuni, come le colture di cellule intestinali o neurali su piastre, sono troppo semplici: non riproducono la complessità tridimensionale dei tessuti, né tengono conto delle interazioni con il microbiota o con il sistema immunitario. In più, spesso utilizzano linee cellulari di origine tumorale o animale, poco rappresentative della fisiologia umana.
I NAMs: una nuova era per la ricerca incentrata sulla biologia umana
È in questo contesto che si inseriscono i New Approach Methodologies (NAMs), un insieme di tecnologie avanzate che promettono di rivoluzionare lo studio della fisiologia umana, riducendo o eliminando l’uso di animali da laboratorio.
Tra queste, una delle più interessanti è quella degli organoidi, strutture tridimensionali coltivate in laboratorio a partire da cellule staminali umane. Si tratta di veri e propri “mini-organi” in vitro, capaci di mimare molte delle funzioni dell’intestino o del cervello umano. Organoidi intestinali, ad esempio, hanno mostrato come i batteri probiotici possano stimolare la produzione di ossitocina, un ormone solitamente associato al cervello, ma che viene prodotto anche a livello intestinale in risposta a stimoli microbici. Questo apre prospettive del tutto nuove per comprendere come il microbiota influenzi emozioni e comportamento.
Un altro studio ha impiegato organoidi cerebrali umani per indagare gli effetti di una molecola chiamata TMAO (ossido di trimetilammina), un metabolita derivato da alimenti ricchi di colina e carnitina come carne rossa, uova e latticini. Il TMAO, prodotto dal metabolismo microbico e successivamente modificato nel fegato, è stato associato a infiammazione sistemica e malattie cardiovascolari. Gli organoidi trattati con TMAO mostravano segni precoci di neurodegenerazione: perdita di neuroni dopaminergici, accumulo di neuromelanina, e alterazioni nelle proteine tau e α-sinucleina, caratteristiche della malattia di Parkinson. Si tratta di una dimostrazione concreta di come dieta e microbiota possano influenzare la salute cerebrale attraverso i metaboliti circolanti.
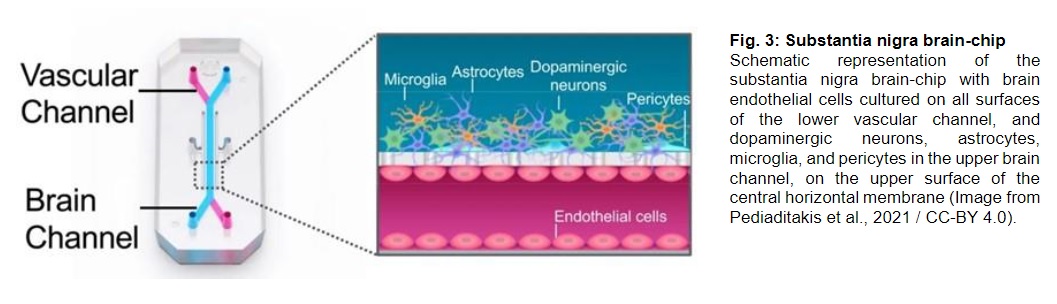
Oltre agli organoidi, i ricercatori stanno sempre più adottando sistemi di organ-on-chip, piattaforme microfluidiche che ricreano l’ambiente fisiologico di un organo umano o di un sistema di organi in modo dinamico. In questi chip, cellule intestinali, epatiche o cerebrali vengono coltivate in camere interconnesse, con un flusso continuo di nutrienti e metaboliti, simulando la circolazione sanguigna. In questo modo è possibile osservare in tempo reale come una sostanza ingerita venga trasformata dal microbiota, metabolizzata dal fegato e infine arrivi al cervello.
In uno di questi modelli multi-organo, ricercatori hanno collegato intestino, fegato e cervello per studiare l’effetto del TMAO lungo l’intera catena metabolica. Hanno osservato che questo composto non solo attraversa la barriera emato-encefalica, ma altera anche l’attività dei neuroni, suggerendo una possibile connessione tra dieta ricca di grassi animali e sviluppo di patologie neurologiche.
Le scienze “omiche”: una mappa molecolare dell’asse intestino-cervello
Accanto ai modelli cellulari, un altro pilastro dei NAMs è rappresentato dalle cosiddette scienze omiche, che comprendono genomica, metagenomica, proteomica, metabolomica ed epigenomica. Grazie a queste tecnologie ad alta capacità, è oggi possibile analizzare milioni di dati molecolari per capire come dieta, microbiota e geni interagiscano nel modulare la salute mentale.
Ad esempio, studi di metabolomica hanno rivelato che alcuni acidi grassi a catena corta, prodotti dalla fermentazione delle fibre alimentari da parte dei batteri intestinali, esercitano un effetto neuroprotettivo riducendo l’infiammazione e rinforzando la barriera emato-encefalica. La metagenomica, invece, permette di identificare profili microbici associati a disturbi psichiatrici, come depressione o schizofrenia, fornendo nuovi biomarcatori e potenziali target terapeutici.
Una transizione necessaria ma non scontata
Nonostante le potenzialità, l’adozione diffusa dei NAMs è ancora ostacolata da barriere tecniche, culturali ed economiche. Molti laboratori non dispongono delle infrastrutture necessarie, e spesso editori e revisori richiedono ancora la “validazione in vivo” tramite animali, anche quando i modelli umani sono più accurati.
Eppure, qualcosa sta cambiando. Negli Stati Uniti, la Food and Drug Administration ha recentemente eliminato l’obbligo di test su animali per i farmaci, e anche in Europa si sta spingendo per adottare sempre più metodologie alternative, in linea con la Direttiva 2010/63/EU che prevede la progressiva sostituzione della sperimentazione animale.
Il futuro della ricerca è animal-free
In un ambito tanto complesso e interconnesso come quello dell’asse intestino-cervello, la scienza non può più permettersi modelli che non riflettano la realtà umana. I NAMs non solo rappresentano un’alternativa etica, ma offrono strumenti potenti per comprendere con maggiore precisione come la dieta influenzi il nostro equilibrio mentale e fisico.
Investire in questi approcci significa migliorare la qualità della ricerca, ridurre gli errori nella traslazione clinica, e avvicinarsi sempre di più a una medicina nutrizionale personalizzata, basata su evidenze del mondo reale.
Articolo originale:
Cassotta, M., Armas Diaz, Y., Qi, Z., Yang, B., Grosso, G., Quiles, J. L., Battino, M., Godos, J., & Giampieri, F. (2025). Modernizing gut-brain axis research in nutritional science: The role of human-centered New Approach Methodologies. Trends in Food Science & Technology, 137, 133–142. https://doi.org/10.1016/j.tifs.2025.03.016